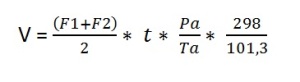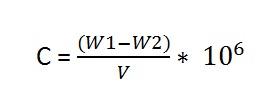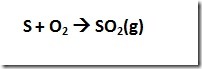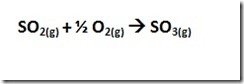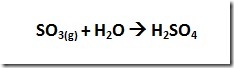Particulate matter (PM) adalah istilah untuk partikel padat atau cair yang ditemukan di udara. Partikel dengan ukuran besar atau cukup gelap dapat dilihat sebagai jelaga atau asap. Sedangkan partikel yang sangat kecil dapat dilihat dengan mikroskop electron. Partikel berasal dari berbagai sumber baik mobile dan stasioner (diesel truk, woodstoves, pembangkit listrik, dll), sehingga sifat kimia dan fisika partikel sangat bervariasi. Partikel dapat langsung diemisika atau terbentuk di atmosfer saat polutan gas seperti SO2 dan NOx bereaksi membentuk partikel halus.
PM-10 Standar merupakan partikel kecil yang bertanggung jawab untuk efek kesehatan yang merugikan karena kemampuannya untuk mencapai daerah yang lebih dalam pada saluran pernapasan. PM-10 termasuk partikel dengan diameter 10 mikrometer atau kurang. Standar kesehatan berdasarkan PP No. 41 Tahun 1999 untuk PM-10 adalah 150 µg/Nm3 (24 jam).
Efek utama bagi kesehatan manusia dari paparan PM-10 meliputi: efek pada pernapasan dan sistem pernapasan, kerusakan jaringan paru-paru, kanker, dan kematian dini. Orang tua, anak-anak, dan orang-orang dengan penyakit paru-paru kronis, influenza, atau asma, sangat sensitif terhadap efek partikel. PM-10 yang asam juga dapat merusak bahan buatan manusia dan merupakan penyebab utama berkurangnya jarak pandang.
PM-10 dianalisa dengan metode gravimetric.

Gbr. Peralatan Analisa PM-10 (http://www.tisch-env.com)
Perhitungan
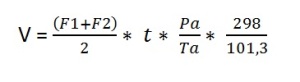 Dimana
Dimana
V = Volume udara yang dihisap ( m 3 )
F1 = Laju alir awal ( m3/ menit )
F2 = Laju alir akhir ( m3/ menit )
t = waktu pengambilan contoh uji ( menit )
Pa = tekanan barometer rata2 selama pengambilan contoh uji ( kpa )
Ta = Temperatur selama pengambilan contoh uji. (°K ).
298 = temperatur pada kondisi normal 25 o C atau 298 K
101,3 = tekanan pada kondisi normal 1 atm ( k Pa )
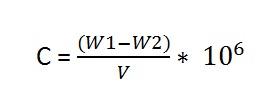
C = Konsentrasi partikulat ( µg/Nm 3 )
W1 = Berat filter sebelum pengambilan contoh udara (gram)
W2 = Berat filter sesudah pengambilan contoh udara (gram)
V = Volume udara yang dihisap ( m 3 )
10^6 = Konversi g ke µg
Daftar Pustaka
www.epa.gov